Spezifische Untersuchungen
Seiteninhalt
- Immunhistologische Untersuchungen
- Nachweis von Infektionserregern
- Markierung von chirurgischen Rändern an Tumormaterial
- Graduierung und Untersuchung prognostischer Marker bei Tumoren
- Molekulare Onkologiediagnostik bei Hund und Katze
- Diagnostik neuromuskulärer Erkrankungen
- Intra vitam-Diagnostik der FIP
- Diagnostik von Infektionskrankheiten bei Reptilien
- BIBD
- Diagnostik gastrointestinaler Entzündungen von Hund und Katze gemäss Empfehlung der WSAVA
- Diagnostische Untersuchung von Leberbiopsien
- Abklärung muskulärer Erkrankungen beim Pferd
- Abklärung auf ziliäre Dyskinesie
- Intraoperative Schnellschnitte
- Scannen von histologischen Schnitten
- Photographische Dokumentation
Immunhistologische Untersuchungen
| Bezeichnung | Spezifikation | Exprimierende Zelltypen |
| ACTH | Adrenocorticotropes Hormon | Zellen des Hypophysenvorderlappens |
| Adipophilin, Perilipin-2 | Oberflächenprotein von Fettvesikeln |
Sebozyten, ausdifferenziert, Subpopulation von Liposarkomen |
| Calcitonin | Hormon | Parafollikuläre (C-)Zellen der Schilddrüse |
| CAM5.2 | Intermediärfilamentprotein Reagiert mit Zytokeratin 8 |
Apokrine Drüsen, Trophoblasten zahlreiche epitheliale Zellen |
| Caspase 3 | grosses Fragment (17/19 kDa) aktivierter Caspase 3 |
Diverse Zelltypen während der Apoptose |
| CD117 | c-kit, Tyrosinkinase | Mastzellen, Cajalzellen, Stammzellen |
| CD18H/K | Hund und Katze: β2-Integrin, Zellmembranprotein |
Makrophagen, Monozyten, Neutrophile, NK-Zellen, Basophile |
| CD20 | B-Zellmarker, Zellmembranprotein | B-Zellen und follikuläre dendritische Zellen |
| CD3 | Oberflächenprotein | T-Lymphozyten |
| CD3 Zyto | Oberflächenprotein | T-Lymphozyten |
| CD31 | Zellmembranprotein | Endothelzellen (Lymph- und Blutgefässe) |
| CD45R | ausschliesslich auf Exon A exprimierte Isoform von CD45 (220 kDa Oberflächenprotein) |
frühe B-Lymphozyten bis reife B-Zellen, auch in aktivierten T-Zellen zu finden, dendritische follikuläre Zellen |
| CD79a | B-Zellmarker, Zellmembranprotein | B-Zellen , Plasmazellen |
| CD79a Zyto | B-Zellmarker, Zellmembranprotein | B-Zellen , Plasmazellen |
| CNPase | Enzym in myelinbildenden Zellen des peripheren und zentralen Nervensystems |
Schwann'sche Zellen, Oligodendrozyten |
| Desmin | Intermediärfilamentprotein | Glatte Muskelzellen, Herz- und Skelettmuskelzellen |
| Faktor VIII | Blutgerinnungsfaktor VIII | Endothelzellen (Lymph- und Blutgefässe) |
| GFAP | Saures Gliafaserprotein | Astrozyten, Ependymzellen des ZNS, zahlreiche Zellen ausserhalb des ZNS |
| Glukagon | Hormon | Glukagonproduzierende Inselzellen (Pankreas) |
| Granzym B (Hund und Katze) |
Protease von zytotoxischen Lymphozyten |
Zytoplasmatische Granula zytolytischer T-Lymphozyten und natürlicher Killer Zellen, auch in Mastzellen nachgewiesen |
| Iba-1 | Ionisiertes kalziumbindendes Molekül 1 |
Mikroglia, Makrophagen und dendritische Zellen im Gewebe (alle Zellen der monozytären Reihe) |
| Insulin | Hormon | Insulinproduzierende Inselzellen (Pankreas) |
| Ka/La | Kappa/Lambda Leichtkette des Ig | Plasmazellen |
| Kappa | Kappa-Leichtkette des Ig | Plasmazellen |
| Ki67 (MIB-1) | Ki67 Antigen | Proliferierende Zellen |
| Lambda | Lambda-Leichtkette des Ig | Plasmazellen |
| Lysozym | Enzym | Monozyten, Makrophagen, Neutrophile, myeloische Vorläuferzellen |
| Melan A | Mart- 1 Zellmembranprotein | Melanozyten |
| Melanoma Pnl-2 | zytoplasmatisches und Membranprotein |
Melanozyten |
| Mesothelial-Cell HBME-1 |
Membranprotein | Mesothelzellen |
| MHC-II | Membranprotein, Zelle, ER etc HLA-DR |
Antigenpräsentierende Zellen, dendritische Zellen, B Zellen, Monozyten auch Endothelium und Thymusepithelzellen |
| Myeloid/Histiozyten Marker(Calprotectin) | zytoplasmatisches Protein | Granulozyten, Monozyten, Makrophagen |
| Myosin Typ1 | Myosinfilament Typ 1 | Skelettmuskelfasern Typ 1 |
| Myosin Typ2 | Myosinfilament Typ 2 | Skelettmuskelfasern Typ 2 |
| NeuN | Neuronen- spezifisches nukleäres Protein |
Neuronen des zentralen und peripheren Nervensystems |
| NSE | Neuronen-spezifische Enolase (zytoplasmatisches Enzym) |
Nervenzellen, neuroendokrine Zellen, Nervenscheidentumoren aber auch Melanome, Germ cell tumours, Seminome, embryonale Karzinome |
| p63 | Nukleäres Protein | Basalzellen, Myoepithelzellen |
| PCK26 | Intermediärfilamentprotein, markiert zahlreiche Zytokeratine |
Plattenepithel- , exokrines und endokrines Drüsenepithel-, Übergangsepithelzellen u.a. |
| Periaxin | Membranprotein von myelinisierten Schwann’schen Zellen |
Myelinisierte Schwann’sche Zellen, Melanozyten |
| S-100 | zytoplasmatisches Protein | Schwann'sche Zellen, Melanozyten |
| SMA | smooth muscle actin Mikrofilamentprotein |
Glatte Muskelzellen |
| Synaptophysin | Protein der synaptischen Vesikel | Nervenzellen, neuroendokrine Zellen |
| Vimentin | Intermediärfilamentprotein | Mesenchymale Zellen |
| Zytokeratin (Clone Lu5) | Intermediärfilamentprotein | Subpopulation epithelialer Zellen, zuverlässig Plattenepithel, nicht sekretorische Zellen |
Zuletzt aktualisiert am: 15.03.2023
Nachweis von Infektionserregern
| Infektionserreger | Diagnostizierte Erkrankung |
| Bornavirus | Bornasche Krankheit |
| Bornavirus, aviär | Infektion mit dem aviären Bornavirus; Proventricular Dilatation Disease |
| BVD Kryo | Antigennachweis von BVDV (Bovines Virusdiarrhoe-Virus) am Gefrierschnitt |
| BVD-P | Antigennachweis von BVDV (Bovines Virusdiarrhoe-Virus) am Paraffinschnitt |
| Canines Adenovirus Typ-1 | Hepatitis contagiosa canis (Hund) |
| Canines und Felines Parvovirus | Parvovirusinfektion (Hund und Katze) |
| Chlamydia spp | Chlamydieninfektionen bei verschiedenen Haustieren |
| Encephalitozoon cuniculi | Enzephalitozoon-Infektion (Kaninchen u.a.) |
| Encephalitozoon hellem | Microsporidiose (Vögel) |
| Equines Herpesvirus Typ 1 (EHV-1) | Herpesvirusaborte, Virale Rhinopneumonitis und Encephalomyelitis beim Pferd |
| Felid Herpesvirus-1 (FeHV-1) | Herpesvirusinfektion bei der Katze |
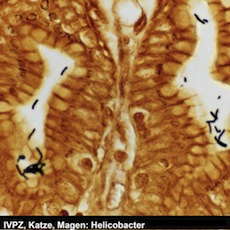
| Felines Coronavirus (FCoV) | Feline infektiöse Peritonitis (FIP) und Coronavirusenteritis (Katze, Frettchen) |
| Influenza A | Influenza A-Infektion |
| Lawsonia intracellularis | Lawsonien-Infektion (Schwein) |
| Leishmania donovani | Leishmaniose (Hund und Pferd) |
| Leptospiren | Leptospirose |
| Listeria monocytogenes* | Listeriose |
| Neospora caninum | Neosporainfektion bei Haustieren |
| Nidoviren (Serpentoviren) bei Pythen | Nidoviruspneumonien und -Infektionen bei Pythen |
| Ovines Herpesvirus | Bösartiges Katarrhalfieber |
| Porcine Epidemic Diarrhea Virus (PEDV) | Epidemische Virusdiarrhoe der Schweine (Porcine Epidemic Diarrhea) |
| Porcines Circovirus Typ-2 | PCV-2-assoziierte Erkrankungen (Schwein) |
| Prionprotein | Bovine spongiforme Enzephalopathie |
| Rabbit Haemorrhagic Disease Virus (RHDV) | Virale hämorrhagische Erkrankung (Kaninchen) |
| RAV (IBD) | Einschlusskörperchen-Erkrankung der Schlangen (BIBD) |
| SARS-CoV-2 (N) | SARS-CoV-2-Infektion |
| Staupevirus (Canine distemper virus, CDV) |
Staupe |
| Tollwutvirus | Tollwut (Haus- und Wildtiere) |
| Toxoplasma gondii | Toxoplasmose |
| West Nile Virus | West Nile Virus-Infektion |
* Die Nachweismethode ist in der Routinediagnostik etabliert, jedoch nicht akkreditiert.
Zuletzt aktualisiert am: 15.03.2023
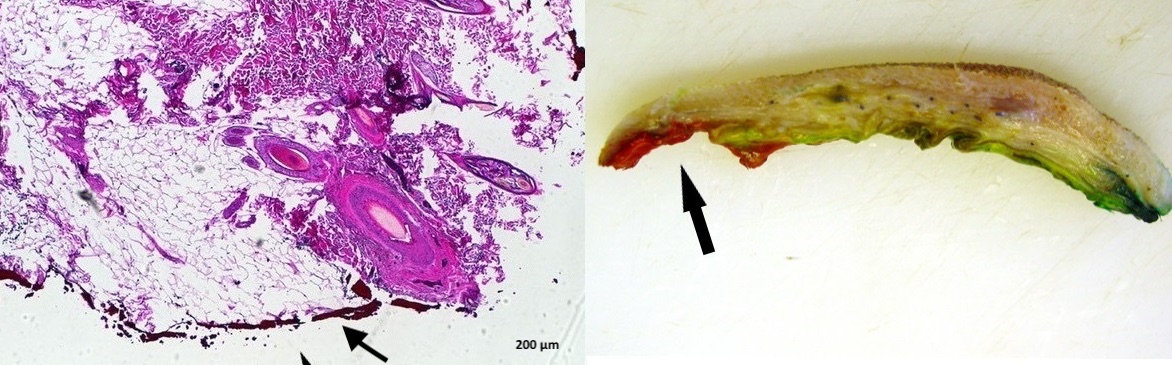
Bei der histopathologischen Beurteilung von Tumoren ist für die weitere Behandlung und die fallspezifische Prognose die Frage nach der Vollständigkeit der Exzision oft fast ebenso wichtig wie die Diagnose selbst. Für deren Beantwortung stellt eine Markierung der Exzisionsränder die Voraussetzung dar.
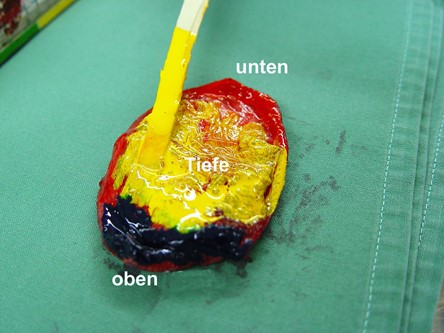
Das Anbringen verschiedener Farben ermöglicht eine eindeutige räumliche Orientierung (Abb. 1) der Probe, die chirurgischen Ränder können sowohl makroskopisch als auch am histologischen Schnitt eindeutig identifiziert werden (Abb. 2).
Optimal ist eine Markierung des frischen Gewebes direkt nach der Entnahme durch die Operateure. Diese können dann bei Bedarf auch Stellen markieren, an denen die Neoplasie aus ihrer Sicht möglicherweise knapp oder gar unvollständig exzidiert worden ist. Diese Frischmarkierung kann aus vielen Gründen nicht möglich sein. Um im Nachhinein dennoch möglichst sichere Angaben zu den Exzisionsrändern zu ermöglichen, bieten wir Ihnen an, am fixierten Material vor der histologischen Aufarbeitung und dem Einbetten eine Farbmarkierung anzubringen..
Hierzu wird die fixierte Gewebeprobe zunächst mit absorbierendem Material abgetrocknet und mit Farben markiert, die innerhalb weniger Minuten trocknen. Im Anschluss daran wird die Probe zugeschnitten. Die Farbe übersteht die Paraffineinbettung und die Färbung der Schnitte und ist somit auch am histologischen Schnitt erkennbar.
Referenz:
D. A. Kamstock et al.: Recommended Guidelines for Submission, Trimming, Margin Evaluation, and Reporting of Tumor Biopsy Specimens in Veterinary Surgical Pathology. Veterinary Pathology, 48(1) 19-31, 2011
Für eine Reihe von Tumoren bei Hund und Katze bieten wir eine Graduierung und/oder die Evaluation prognostischer Marker an: Mastzelltumoren, orale und dermale Melanome, Spindelzellsarkome und Mammatumoren insbesondere beim Hund. Diese Hilfsmittel ermöglichen eine feinere Einschätzung des biologischen Verhaltens von Tumoren. Die Graduierungssysteme basieren auf der Beurteilung von morphologischen Kriterien (wie beispielsweise der Anzahl Mitosen, der Kernmorphologie und dem Grad der Zelldifferenzierung), die im Wesentlichen mit dem Proliferations- und Metastasierungspotential der Tumoren korrelieren. Bei den prognostischen Markern wird mittels Immunhistologie die Anwesenheit, Menge oder Verteilung von bestimmten Proteinen im Tumorgewebe untersucht. Etablierte Beispiele davon sind der Marker Ki67, der sich in Teilung befindende Zellen markiert, oder der Marker c-Kit, der je nach Malignität eine unterschiedliche Lokalisation in den Zellen zeigt. Zusammen mit morphologischen und klinischen Daten erlauben die Resultate der immunhistologischen prognostischen Bewertung und Graduierung die Einschätzung der Prognose dieser Neoplasien und unterstützen die Entscheidung für die Wahl der Therapie.
Wir arbeiten eng mit den Kollegen an der Universität Liverpool (Division of Veterinary Pathology, School of Veterinary Science, University of Liverpool) und hier besonders mit Dr. Lorenz Ressel, zusammen. Dies erfolgt insbesondere in der Abgleichung und Qualitätssicherung der Immunhistologie zur prognostischen Beurteilung und Graduierung.
Literatur
- Dennis MM, McSporran KD, Bacon NJ, Schulman FY, Foster RA, Powers BE, 2011. Prognostic factors for cutaneous and subcutaneous soft tissue sarcomas in dogs. Vet Pathol 48,73-84.
- Goldschmidt M, Peña L, Rasotto R, Zappulli V, 2011. Classification and grading of canine mammary tumors. Vet Pathol 48:117-31.
- Kiupel M, Webster JD, Bailey KL, Best S, DeLay J, et al., 2011. Proposal of a 2-tier histologic grading system for canine cutaneous mast cell tumors to more accurately predict biological behavior. Vet Pathol 48, 147-55.
- Ressel L, Puleio R, Loria GR, Vannozzi I, Millanta F, Caracappa S, Poli A, 2013. HER-2 expression in canine morphologically normal, hyperplastic and neoplastic mammary tissues and its correlation with the clinical outcome. Res Vet Sci 94(2), 229-305.
- Smedley RC, Spangler WL, Esplin DG, Kitchell BE, Bergman PJ, Ho HY, Bergin IL, Kiupel M, 2011. Prognostic markers for canine melanocytic neoplasms: a comparative review of the literature and goals for future investigation. Vet Pathol 48,54-72.
- Webster JD1, Yuzbasiyan-Gurkan V, Miller RA, Kaneene JB, Kiupel M, 2007. Cellular proliferation in canine cutaneous mast cell tumors: associations with c-KIT and its role in prognostication. Vet Pathol 44,298-308.
Molekulare Onkologiediagnostik bei Hund und Katze
"Lymphom versus IBD"
Zur Abklärung dieser nicht seltenen Problematik arbeiten wir mit einem molekulardiagnostischen Partnerlabor (Genefast, Forlì, Italien) zusammen. Wir können Ihnen eine Klonalitätsanalyse mittels PARR-Untersuchung anbieten. Der Preis für diese zusätzliche Untersuchung, die wir an formalinfixiertem Material, an unfixierten Biopsien sowie an zytologischen Präparaten durchführen können, liegt bei CHF 140.00.
Prognostik Mastzelltumor Hund und Katze
Ebenfalls in Zusammenarbeit mit unserem Partnerlabor (Genefast) bieten wir Ihnen zusätzlich zu unserem immunhistologischen Diagnostikpanel beim Hund für Mastzellentumoren von Hund und Katze ein molekularbiologisches Nachweispanel einer c-Kit Mutation an, das sehr nützliche prognostische Informationen liefern kann. Der Preis für diese Untersuchung, die ebenfalls an formalinfixiertem Material, unfixierten Biopsien sowie zytologischen Präparaten durchgeführt werden kann, liegt zwischen CHF 90.00 und 150.00.
Bitte wenden Sie sich bei Fragen zu den molekulardiagnostischen Untersuchungen an Dr. Christiane Krudewig (christiane.krudewig@uzh.ch).
Onkologiediagnostik Hund- Nachweis der BRAF-Variante V595E beim Harnblasenkarzinom und beim urethralen Prostatakarzinom
Indikation
Erkrankungen des Urogenitaltraktes des Hundes mit Differenzialdiagnose Harnblasenkarzinom oder urethrales Prostatakarzinom. Als Material kann zunächst nicht invasiv gewonnenes, zellreiches Urinsediment dienen. Hieran erfolgt der Nachweis der BRAF-Variante V595E mittels PCR und anschliessender Sequenzierung. Ein positives Ergebnis spricht für das Vorliegen eines Karzinoms. Die Diagnose sollte durch weiterführende Untersuchungen (Ultraschall, histologische Untersuchung einer Biopsie) bestätigt und spezifiziert werden. Des Weiteren können (bereits untersuchte) zytologische und histologische Proben, z.B. wenn keine eindeutige morphologische Diagnose gestellt werden kann, ebenfalls auf die Mutation untersucht werden.
Hintergrundinformation
Das Übergangszellkarzinom ist die häufigste Krebsart des Urogenitaltraktes des Hundes. Zum Zeitpunkt der Diagnose präsentieren sich die meisten Fälle als invasive Tumoren (Patrik et al., 2006; Grassinger et al., 2019). Neuere Studien zeigen, dass bei einem grossen Teil der Harnblasenkarzinome sowie der urethralen Prostatakarzinome eine bestimmte BRAF-Punktmutation, die BRAF-Variante V595E (67% bzw. 80%), vorliegt. Der Nachweis der V595E-Variante ist aus Urinsediment, Formalinmaterial oder zytologischen Ausstrichen möglich und spricht nach derzeitigem Erkenntnisstand für das Vorliegen eines Karzinoms des unteren Urogenitaltraktes (Harnblasen- oder Prostatakarzinom), da diese Mutation bisher ausschliesslich bei Karzinomen der Harnblase oder der Prostata und nicht bei entzündlichen Erkrankungen oder Kontrollgewebe nachgewiesen wurde (Mochizuki et al., 2015; Aupperle-Lellbach et al., 2018; Grassinger et al., 2019).
Einzusendendes Material und Methode
PCR mit Sequenzierung anhand von folgendem Material: Zytologische Präparate (gefärbt und ungefärbt), Formalinmaterial (fixierte Gewebeproben oder Paraffinmaterial) sowie zellreiches Urinsediment (letzteres nach Anfrage).
Aussagekraft: Die Spezifität der Untersuchung ist hoch (100%); ein negatives Ergebnis schliesst das Vorliegen eines Tumors jedoch nicht vollständig aus.
Haben Sie Fragen? Bitte wenden Sie sich per Email an: ivpzdl@vetpath.uzh.ch
Referenzen
- Grassinger JM, Merz S , Aupperle-Lellbach H, Erhard H, Klopfleisch R, 2019. Correlation of BRAF variant V595E, reed, histological grade and cyclooxygenase-2 expression in canine transitional cell carcinomas. Vet Sci 6(1), 31.
- Patrick D, Fitzgerald S, Sesterhenn A, Davis C, Kiupel M, 2006. Classification of canine urinary bladder urothelial tumours based on the World Health Organization/International Society of Urological Pathology consensus classification. J Comp Pathol 135, 190-199.
- Mochizuki H, Shapiro SG, Breen M, 2015. Detection of BRAF mutation in urine DNA as a molecular diagnostic for canine urothelial and prostatic carcinoma. PLoS One 2015;10(12):e0144170.
- Aupperle-Lellbach H, Grassinger J, Hohloch C, Kehl K, Pantke P, 2018. Diagnostische Aussagekraft der BRAF-Mutation V595E in Urinproben, Ausstrichen und Bioptaten beim kaninen Übergangszellkarzinom. Tierärztliche Praxis Kleintiere/Heimtiere 46 (K), Heft 5, 289-295.
Diagnostik neuromuskulärer Erkrankungen
Die histologische Untersuchung von Skelettmuskel- und peripheren Nervenbiopsien ist ein wertvolles Instrument für die Diagnose und pathogenetische Bewertung neuromuskulärer Erkrankungen. Der Diagnostikdienst für neuromuskuläre Erkrankungen bietet dem Kliniker eine möglichst genaue Diagnose von Muskelerkrankungen bei Haustieren.
Unser Diagnostikservice nutzt eine hochmoderne Palette morphologischer und histoenzymatischer Färbungen für Skelettmuskelbiopsien, um zwischen verschiedenen Muskelerkrankungen wie Muskeldystrophien, metabolischen Myopathien (z.B. Polysaccharid-Speichermyopathien), mitochondrialen Myopathien und entzündlichen Myopathien zu unterscheiden. Wir bieten eine Reihe von Diagnostikpanels an, die sich nach dem klinischen Zustand und der klinischen Verdachtsdiagnose richten. Ein Kernpanel für die morphologische Untersuchung der Probe in Kombination mit histoenzymatischen Färbungen dient der Untersuchung oxidativer Enzyme. Mehrere Panels, die auch histochemische und immunhistochemische Färbungen umfassen, können zusätzlich für eine spezifischere Beurteilung verschiedener Erkrankungen, wie Polysaccharid-Speicher-Myopathien, entzündliche Myopathien und Muskeldystrophien, durchgeführt werden.
Für periphere Nervenbiopsien wird ein spezielles Einbettungs- und Färbeverfahren angewandt, welches das Auftreten von Artefakten vermindert und eine exakte Beurteilung peripherer Neuropathien, einschliesslich Demyelinisierung und Entzündung, ermöglicht.
Die Berichterstattung erfolgt in Englisch. Bitte nehmen Sie mit uns Kontakt auf, falls eine Übersetzung in Deutsch notwendig ist.
Leitlinien für die Entnahme von Muskelbiopsien
Für eine angemessene histologische Beurteilung von Muskelbiopsien sind frische, unfixierte Proben erforderlich. Im Falle von Skelettmuskelgewebe verwenden wir schockgefrorenes Frischgewebe. Dadurch wird das Auftreten von durch Formalinfixierung und Paraffineinbettung verursachten Artefakten vermieden und werden Enzymuntersuchungen ermöglicht.
Idealerweise sollte die Probe nach der Entnahme sofort gefroren werden, insb. wenn biochemische Untersuchungen geplant sind. Dennoch können auch an Proben, die mehrere Stunden vor dem Gefrieren entnommen wurden, angemessene morphologische Untersuchungen durchgeführt werden.
Auswahl der Muskeln für die Biopsie
- Chronische Krankheit: Muskeln mit mässiger, aber nicht schwerer Schwäche.
- Akute Erkrankung: Muskeln mit schwerer oder mittelschwerer Schwäche.
- In schwierigen Fällen kann die MRT dazu dienen, pathologisch veränderte Muskelstellen auszuwählen.
- Vermeiden Sie die Entnahme von Muskeln, an denen eine EMG durchgeführt wurde oder Injektionen verabreicht wurden.
Muskelproben sollten mindestens 1.5 cm lang, 1 cm breit und 1 cm dick sein, wobei die Fasern in Längsrichtung ausgerichtet werden sollen.
Transport
Die Muskelbiopsie muss
- auf eine mit Kochsalzlösung befeuchtete (ca. 20 Tropfen) Gaze gelegt werden,
- in die Gaze eingewickelt und in einen sauberen, luftdichten Behälter gelegt werden,
- kühl gehalten werden (ca. 4°C), wenn der Transport länger als ein paar Minuten dauert (die Temperatur kann mit Kühlelementen in einem Behälter aus Styropor aufrechterhalten werden).
- das Labor innerhalb von weniger als 24 Stunden nach der Entnahme erreichen (Übernacht-Kurier).
Falls verfügbar, sollte eine zweite Muskelbiopsie in 10% gepuffertes Formalin als Reserveprobe eingelegt werden.
Die Frischgewebeprobe sollte NICHT in Kochsalzlösung, Fixiermittel oder andere Flüssigkeiten getaucht werden.
Vermeiden Sie es, Proben am Ende der Woche (Donnerstag, Freitag) per Kurier zu versenden, da unerwartete Ereignisse die Probenlieferung über das Wochenende hinaus verzögern und die Probe unbrauchbar machen könnten.
Wenn Sie Fragen zur Probenahme und zum Transport haben, können Sie sich gerne an uns wenden (044 635 85 84).
Leitlinien für die Entnahme von Nervenbiopsien
Für eine adäquate histologische Beurteilung sollte die Nervenbiopsie mind. 10 mm lang sein und unmittelbar nach der Entnahme in 10% gepuffertes Formalin eingelegt werden. Die Probe kann bei Raumtemperatur aufbewahrt werden, bis sie an das IVPZ geschickt wird. Nach der Fixierung in Formalin kann die Nervenbiopsie wie jede andere formalinfixierte Biopsieprobe für die histologische Untersuchung behandelt und versandt werden.
Letzte Aktualisierung: 07.08.2023
Eine FIP intra vitam definitiv zu diagnostizieren, stellt nach wie vor eine Herausforderung dar. Neben den verschiedensten molekularbiologische Ansätzen, bietet die Pathologie verschiedene diagnostische Möglichkeiten, deren Vorteil es ist, dass neben der Bestätigung oder dem Ausschluss einer FIP insb. im letzteren Fall auch differentialdiagnostische Aspekte berücksichtigt werden können.
1. Diagnose anhand von zytologischen Präparaten von Ergüssen oder veränderten Organen
Die Untersuchung von mit FIP assoziierten Körperhöhlenergüssen ermöglicht in vielen Fällen eine definitive Diagnose. Optimale Ergebnisse ergibt die Untersuchung von Zellpellets, die durch Zentrifugieren von Ergussproben gewonnen werden.
Auch Ausstriche von Ergussproben (v.a. bei geringen Ergussmengen) sowie von veränderten Organen (z.B. Netz, Mesenteriallymphknoten) können untersucht werden.
Wir führen an den Präparaten eine zytologische Untersuchungen sowie eine immunzytologische Untersuchung zum Nachweis von Felinem Coronavirus (FCoV) durch. Der Nachweise von Virusantigen in Makrophagen erlaubt eine definitive Diagnose.
Die zytologische Untersuchung erlaubt bei fehlendem Virusantigen-Nachweis in einigen Fällen auch den Ausschluss von FIP und die Diagnose einer anderen Erkrankung. Probenvorbereitung und -einsendung (siehe auch Flowcharts).
A. Körperhöhlenergüsse
- Entnahme einer Ergussprobe
- Zentrifugieren der frisch entnommenen Flüssigkeit (in 1.5 ml Eppendorfröhrchen) zur Gewinnung eines Zellpellets
- Überschichten des Zellpellets mit Formalin und Einsendung
- falls keine Möglichkeiten zur Herstellung des Zellpellets: sofortiges Einsenden der frisch entnommenen Ergussprobe
- bei geringer Ergussmenge: Präparation von 3 Ausstrichen, Lufttrocknen, Einsenden
B. Feinnadelaspirate von vermutlichen FIP-Läsionen
- Präparation von 3 Ausstrichen, Lufttrocknen, Einsenden
Unsere Untersuchungen
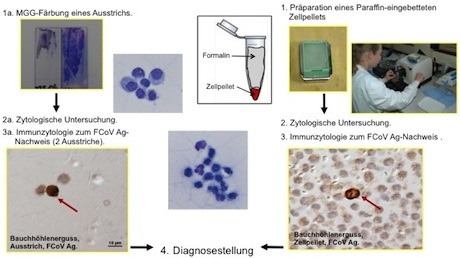
Probenvorbereitung und -einsendung

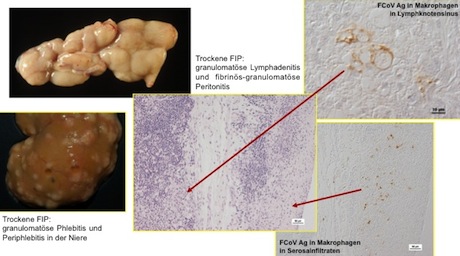
2. Diagnose anhand von Biopsien aus vermutlichen FIP-Läsionen
Biopsien von Organen mit vermuteten FIP-Läsionen (z.B. Netz, Mesenteriallymphknoten, Niere) werden histologisch beurteilt. Die definitive Diagnose einer FIP erfolgt mittels des immunhistologischen Nachweises von FCoV-Antigen in Makrophagen in den Läsionen.
Die histologische Untersuchung vermuteter FIP-Läsionen ermöglicht auch die differentialdiagnostische Beurteilung und erlaubt auch bei Ausschluss einer FIP häufig eine Diagnosestellung.
FIP-Diagnostik an Biopsien von Läsionen
Literatur
- Cammarata Parodi M, Cammarata G, Paltrinieri S, 1993. Using indirect immunofluorescence to detect coronaviruses in peritoneal and pleural effusions. J Sm Anim Pract 34(12), 609-613.
- Giordano A, Paltrinieri S, Bertazzolo W, Milesi E, Parodi M, 2005. Sensitivity of Tru-cut and fine needle aspiration biopsies of liver and kidney for diagnosis of feline infectious peritonitis. Vet Clin Pathol 34(4), 368-374.
- Kipar A, Bellmann S, Kremendahl J, Köhler K, Reinacher M, 1998. Cellular composition, coronavirus antigen expression and production of specific antibodies in lesions in feline infectious peritonitis. Vet Immunol Immunopathol 65, 243-257.
- Kipar A, Meli ML, 2013. Feline infectious peritonitis: Still an enigma? Vet Pathol 51(2), 506-526.
- Litster A, Pogranichniy R, Lin T-L, 2013. Diagnostic utility of a direct immunofluorescence test to detect feline coronavirus antigen in macrophages in effusive feline infectious peritonitis. Vet J 198, 362-366.
Diagnostik von Infektionskrankheiten bei Reptilien
Diagnostik der Einschlusskörperchen-Krankheit der Boiden (Boid inclusion body disease; BIBD)
Die BIBD kann anhand des histologischen oder zytologischen Nachweises der typischen intrazytoplasmatischen Einschlusskörperchen diagnostiziert werden.
Diagnose am lebenden Tier: Da die für BIBD typischen Einschlusskörperchen auch in Erythrozyten und Leukozyten des peripheren Blutes nachweisbar sind, kann die Diagnose BIBD auch intra vitam gestellt werden. Hierzu benötigen wir zwei ungefärbte, luftgetrocknete Blutausstriche.
Diagnose an fixierten Gewebeproben: Eine histologische Untersuchung von formalinfixierten Gewebeproben (z.B. Leber) mit anschliessendem immunohistologischen Nachweis von Reptarenavirus-Antigen ermöglicht eine definitive Diagnose der BIBD.
Nachweis der Reptarenavirusinfektion: BIBD ist eine ansteckende Krankheit, der eine Infektion mit Arenaviren zugrundeliegt. Infizierte Tiere müssen nicht zwingend an BIBD erkrankt sein, stellen jedoch mit sehr grosser Wahrscheinlichkeit eine Infektionsquelle für andere Tiere dar. Den Nachweis einer Infektion mit BIBD-assoziierten Arenaviren (Reptarenaviren) führen wir an EDTA-Blut sowie an Gewebeproben durch. Wir wenden eine spezifische PCR an, die die nach unserer Erfahrung am weitesten verbreiteten Reptarenaviren erkennt. Für den Test am lebenden Tier benötigen wir 0.2-0.5 ml EDTA Blut (gekühlt), wobei die o.g. 2 ungefärbten Blutausstriche mitgesandt werden sollten, um gleichzeitig die BIBD-Diagnostik zu ermöglichen. Bei einer Sektion oder Laparotomie entnommene unfixierte Gewebeproben (z.B. Leber) können auf gleiche Weise bearbeitet werden. Eine parallel eingesandte formalinfixierte Gewebeprobe dient wiederum der BIBD-Diagnose. In fraglichen Fällen kann auch eine Inokulation von spezifisch sensitiven Gewebekulturen mit Blut- oder Gewebeproben durchgeführt werden.
Diagnose am toten Tier: Die Diagnose einer BIBD und der assoziierten Reptarenavirusinfektion kann mit grösstmöglicher Sicherheit an getöteten oder gestorbenen Schlangen gestellt werden, da in diesem Fall neben der makroskopischen Beurteilung eine histologische Untersuchung eines breiten Gewebespektrums erfolgt. Die Befunde werden mittels Immunhistologie bestätigt.
Literatur
- Chang L, Jacobson ER, 2010. Inclusion body disease, a worldwide infectious disease of boid snakes: a review. J Exotic Pet Med 19, 216-225.
- Hetzel U, Sironen T, Laurinmäki L, Patjas A, Henttonen H, Vaheri A, Artelt A, Kipar A, Butcher SJ, Vapalahti O, Heppojoki J, 2013. Isolation, identification, and characterization of novel arenaviruses, the etiological agents of boid inclusion body disease. J Virol 87(29), 10918-10935.
- Hepojoki J, Salmenperä P, Sironen T, Hetzel U, Korzykov Y, Kipar A, Vapalahti O, 2015. Arenavirus co-infections are common in snakes with boid inclusion body disease. J Virol 89(16), 8657-8660.
- Keller S, Hetzel U, Sironen T, Korzyukov Y, Vapalahti O, Kipar A, Hepojoki J. Co-infecting reptarenavirus species can be vertically transmitted in boa constrictor. PLoSPathogens 2017 Jan 23;13(1):e1006179.
Serpentovirus-assoziierte Pneumonie bei Pythen
Serpentoviren waren in der Vergangenheit v.a. im Zusammenhang mit Darmerkrankungen bei Säugetieren bekannt. Vor Kurzem wurden sie allerdings als wahrscheinliche Ursache für eine "mukoide Pneumonie" beim Königspython (P. regius) und einem Tigerpython (P. molurus) beschrieben. Wir haben seit 2014 eine deutliche Zunahme einer vergleichbaren Erkrankung beim grünen Baumpython (Morelia viridis) beobachtet. Diese stellt sich klinisch als akut einsetzende, oft zum Tod führende Atemnot dar. Da das Virus den gesamten Atmungstrakt infiziert, findet die Übertragung höchstwahrscheinlich über die Atemwege statt (aerogen).
Zum Nachweis von Serpentoviren bei Pythen haben wir einen molekularbiologischen Test (spezifische PCR) entwickelt, der alle bisher beschriebenen Serpentoviren (ehem. Nidoviren) detektiert.
Diagnose am lebenden Tier: Bei lebenden Schlangen kann der Virusnachweis an Tracheal- und Lungenspülproben versucht werden, wobei ein positives PCR-Ergebnis die Infektion bestätigt, ein negatives Ergebnis jedoch eine Infektion leider nicht ausschliessen kann. Der Nachweis einer Infektion bedeutet vermutlich nicht zwingend, dass das Tier klinisch erkrankt ist oder erkranken wird, ebenso können wir momentan noch keine Aussage dazu machen, ob eine Erkrankung (Serpentovirus-assoziierte Pneumonie) generell tödlich verläuft.
Diagnose am toten Tier: Die Diagnosestellung kann am Tierkörper oder an Lungengewebe erfolgen. Unsere Forschungsergebnisse belegen, dass Nidoviren den gesamten Atmungstrakt sowie in einzelnen Fällen auch andere Organsysteme infizieren können. Der sichere Nachweis einer Nidovirusinfektion erfolgt dennoch optimalerweise an Lungengewebe. Hierfür bieten wir zwei unterschiedliche Nachweismethoden an.
- Histologische und immunhistologische Untersuchung von fixiertem Lungengewebe: Eine histologische Untersuchung von formalinfixierten Lungengewebe mit anschliessendem immunohistologischen Nachweis von NSerpentovirus-Antigen ermöglicht die definitive Diagnose einer Serpentovirus-assoziierten Pneumonie, da hier gleichzeitig die Serpentovirusinfektion nachgewiesen wird und die typischen histologischen Veränderungen im Rahmen der Lungenentzündung beurteilt werden.
- PCR-Untersuchung von unfixiertem Lungengewebe: An postmortal entnommenen und gekühlt eingeschickten unfixierten Lungenproben kann mittels PCR der Virusnachweis erfolgen. Hier ist zu beachten, dass ein Nachweis der Infektion nur in Zusammenhang mit den pathognomonischen Lungenveränderungen und klinischen Symptomen bestätigend für die Erkrankung ist.
Literatur
-
Stenglein MD, Jacobson ER, Wozniak EJ, Wellehan JFX, Kincaid A, Gordon M, Porter BF, Baumgartner W, Stahl S, Kelley K, Towner JS, DeRisi JL. 2014. Ball python nidovirus. A candidate etiologic agent for severe respiratory disease in Python regius. mBio 5:e01484-14-e01484-14.
-
Uccellini L, Ossiboff RJ, Matos REC de, Morrisey JK, Petrosov A, Navarrete-Macias I, Jain K, Hicks AL, Buckles EL, Tokarz R, McAloose D, Lipkin W. 2014. Identification of a novel nidovirus in an outbreak of fatal respiratory disease in ball pythons (Python regius). Virol J 11:144.
-
Bodewes R, Lempp C, Schurch AC, Habierski A, Hahn K, Lamers M, Dornberg K von, Wohlsein P, Drexler JF, Haagmans BL, Smits SL, Baumgartner W, Osterhaus, A. D. M. E. 2014. Novel divergent nidovirus in a python with pneumonia. Journal of General Virology 95:2480–2485.
-
Dervas E, Hepojoki J, Keller S, Jelinek C, Laimbacher A, Kipar A, Hetzel U. 2016. Nidovirus infection of green tree pythons: Identification and morphological features of a fatal respiratory disease in Morelia viridis. Journal of Comparative Pathology. 156 (1): 56.
Chlamydiendiagnostik bei der Schlange
Kürzlich konnte gezeigt werden, dass nicht nur Chlamydia pneumoniae bei Schlangen bzw. anderen Reptilien vorkommt, sondern auch neue bis anhin unbekannte Chlamydienspezies. Chlamydieninfektionen bei Schlangen könnten zu granulomatösen Entzündungen in den inneren Organen, proliferativen Pneumonien, Enteritis, Myokarditis aber auch zu klinisch inapparenten Infektionen führen. Allenfalls können subklinische Infektionen unter Stressbedingungen auch mit unerwarteten Todesfällen enden.
Eine Infektion mit Chlamydien kann mittels einer real-time PCR Untersuchung anhand von Tupferproben aus der Choanae und/oder Kloake diagnostiziert werden. Hierzu benötigen wir spezielle Abstrichtupfer ohne Medium (flocked swab, Firma Copan), die wir gerne auf Anfrage zur Vefügung stellen. Mit diesen Abstrichtupfer werden auch Epithelzellen gewonnen, in denen sich die Chlamydien als obligat intrazelluläre Bakterien vermehren. Im Falle eines positiven Nachweises mit der real-time PCR, werden die Chlamydien-positiven Proben mit weiterführenden Arraymate- oder PCR-Methoden genauer charakterisiert.
Post mortem kann eine Chlamydieninfektion mittels Histologie in Kombination mit Immunhistochemie und/oder PCR in Organläsionen diagnostiziert werden.
Literatur
- Rüegg SR, Regenscheit N, Origgi FC, Kaiser C, Borel N, 2015. Detection of Chlamydia pneumoniae in a collection of captive snakes and response to treatment with marbofloxacin. Vet J 205, 424-426.
- Soldati G, Lu ZH, Vaughan L, Polkinghorne A, Zimmermann DR, Huder JB, Pospischil A, 2004. Detection of mycobacteria and chlamydiae in granulomatous inflammation of reptiles: a retrospective study. Vet Pathol 41, 388–397.
- Taylor-Brown A, Bachmann NL, Borel N, Polkinghorne, 2016. Culture-independent genomic characterisation of Candidatus Chlamydia sanzinia, a novel uncultivated bacterium infecting snakes. BMC Genomics 17, 710.
- Taylor-Brown A, Rüegg S, Polkinghorne A, Borel N, 2015. Characterisation of Chlamydia pneumoniae and other novel chlamydial infections in captive snakes. Vet Microbiol, 178, 88-93.
BIBD
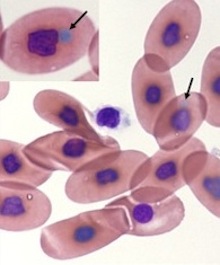
BIBD ist eine Infektionskrankheit, der eine Infektion mit Arenaviren zugrundeliegt. Infizierte Tiere müssen nicht zwingend an BIBD erkrankt sein, stellen jedoch mit sehr grosser Wahrscheinlichkeit eine Infektionsquelle für andere Tiere dar. Den Nachweis einer Infektion mit BIBD-assoziierten Arenaviren (BIBDAV) führen wir an EDTA-Blut, optimalerweise ergänzt durch Rachen- und Kloakentupfer, durch. An diesen Proben führen wir eine BIBDAV-spezifische PCR, in fraglichen Fällen auch eine Inokulation von spezifisch BIBDAV-sensitiven Gewebekulturen durch. Wir benötigen für diese Tests neben den o.g. zwei ungefärbten Blutausstrichen 0.2 - 0.5 ml EDTA Blut (gekühlt) und, wenn möglich, Rachen- und Kloakentupfer.
Literatur
- Chang L, Jacobson ER, 2010. Inclusion body disease, a worldwide infectious disease of boid snakes: a review. J Exotic Pet Med 19, 216-225
- Hetzel U, Sironen T, Laurinmäki L, Patjas A, Henttonen H, Vaheri A, Artelt A, Kipar A, Butcher SJ, Vapalahti O, Heppojoki J, 2013. Isolation, identification, and characterization of novel arenaviruses, the etiological agents of boid inclusion body disease. J Virol 87(29), 10918-10935.
Die Diagnose und Behandlung gastrointestinaler Erkrankungen bei Hund und Katze basieren in vielen Fällen auf der Beurteilung von endoskopisch gewonnenen Magen- und Darmbiopsien. Die histologische Beurteilung von Schleimhaut- (oder Vollschicht-)bioptaten ermöglicht häufig die Abgrenzung von entzündlichen und tumorösen Prozessen, bei ersteren die Klassifizierung und Schweregradbeurteilung der Entzündungen und bei letzteren die Unterscheidung von malignen und benignen Neoplasien. Um eine möglichst gute Probenqualität zu erzielen, wird empfohlen, aus jedem Magen-Darm-Abschnitt (Magen, Duodenum/proximales Jejunum, Colon) mindestens acht Bioptate zu entnehmen. Besteht der Verdacht auf eine Neoplasie, sollten aus verdickten Magen-Darmwandabschnitten tiefe Biopsien entnommen werden, da wandassoziierte maligne Prozesse oft von einer histologisch eher unauffälligen Schleimhaut überdeckt sind.
Entzündliche Veränderungen in Gewebeproben des Gastrointestinaltraktes von Hund und Katze werden auf Basis der Standards der WSAVA (World Small Animal Veterinary Association) Gastrointestinal Standardization Group (Day et al., 2008) beurteilt und können auf Anfrage gemäss des von der Gruppe empfohlenen Formulars übermittelt werden.
Literatur
- Day MJ, Bilzer T, Mansell J, Wilcock B, Jergens A, Minami T, Willard M, Washabau R, 2008. Histopathological standards for the diagnosis of gastrointestinal inflammation in endoscopic biopsy samples from the dog and cat: a report from the World Small Animal Veterinary Association Gastrointestinal Standardization Group. J Comp Path 138 (Suppl 1), S1-S43.
Diagnostische Untersuchung von Leberbiopsien
Viele Lebererkrankungen von Hunden und Katzen können anhand einer histologischen Untersuchung diagnostiziert werden. Insb. entzündliche, toxische und metabolische Parenchymerkrankungen, Veränderungen der Gallengänge und Neoplasien lassen sich oft erfassen. Neben der Diagnosestellung ist eine Biopsie häufig auch hilfreich, um Auskunft über den Verlauf (Chronizität) einer Erkrankung zu bekommen (Fibrose).
Eine möglichst vollständige Anamnese hilft uns bei der Interpretation. Benötigt werden: Signalement, Vorgeschichte, Laborwerte (Leberenzyme, Blutstatus usw.), Ergebnisse von diagnostischen Untersuchungen (Ultraschall, exploratorische Laparoskopie, frühere histologische oder zytologische Untersuchungen).
Diffuse Prozesse sind häufig in Tru-cut-Biopsien erkennbar, während lokale Prozesse oft eher mittels der Untersuchung einer grösseren Probe (wedge biopsy) erfasst werden können.
Die wichtigsten Indikationen für eine Leberbiopsie sind:
- abnorme Leberenzyme während längerer Zeit (mind. ein Monat)
- Hepatomegalie unbekannter Ursache
- systemische Erkrankungen, die auch die Leber betreffen
- Staging von Neoplasien
- Beurteilung eines therapeutischen Erfolges
Die Anwendung weniger Spezialfärbungen kann die Aussagekraft der histologischen Untersuchung häufig erhöhen und ist bei einigen (z.B. Kupfer-assoziierten) Hepatopathien unerlässlich.
Wir bieten daher neu ein "Leber-Panel" an. Dazu gehören neben der normalen Hämatoxyin-Eosin- (HE-)Färbung auch solche Färbungen, die es ermöglichen, frühe fibrotische Veränderungen sowie die Zerstörung der Architektur zu entdecken (Masson’s Trichrome, Retikulin-Färbung), sowie Färbungen zum Nachweis von Glykogen (PAS-Reaktion) und für Pigmente (v.a. Eisen, Lipofuszin, Kupfer). Je nach klinischem Verdacht und Einschätzung des/der Patholog*in wird daher das "Leber-Panel" aus einer HE- und 4 Spezialfärbungen zusammengestellt.
Abklärung muskulärer Erkrankungen beim Pferd
Zur Abklärung von Myopathien beim Pferd, insb. der Equinen Polysaccharide Storage Myopathy (EPSM, Polysaccharide Speichermyopathie), aber auch der Equinen Motor Neuron Disease (EMND) bieten wir eine Kombination von Routine- und Spezialfärbungen (HE, PAS Färbung, PAS Färbung mit Diastasebehandlung) an. Auf Wunsch ist mittels immunhistologischer Untersuchung eine Bestimmung von Typ 1 und Typ 2 Fasern möglich.
Für die Untersuchung werden formalinfixierte Muskelproben benötigt, die im Fall der EPSM idealerweise aus dem M. semimembranosus und/oder M. semitendinosus, bei der EMND dagegen aus dem M. sacrocaudalis entnommen werden. Idealerweise wird die Probe auf einen Holzspatel oder einen dicken Karton gelegt, um zu verhindern, dass sie sich bei der Fixierung aufrollt, was die optimale Ausrichtung für die histologische Untersuchung erschweren kann. Gleichzeitig können die Proben auch auf entzündliche oder andere degenerative Erkrankungen untersucht werden.
Literatur
- McGowan CM, Menzies-Gow NJ, McDiarmid AM, Patterson-Kane JC, 2003. Four cases of equine polysaccharide storage myopathy in the United Kingdom. Vet Rec 152, 109-112.
- Valentine BA, Divers TJ, Murphy DJ, Todhunter PG, 1998. Muscle biopsy diagnosis of equine motor neuron disease and equine polysaccharide storage myopathy. Equine Vet Ed 10(1), 42-50.
- Valentine BA, Cooper NJ, 2005. Incidence of polysaccharide storage myopathy: necropsy study of 225 horses. Vet Pathol 42(6), 823-827.
Die Diagnose der ziliären Dyskinesie beim Hund basiert auf der elektronenmikroskopischen Beurteilung des respiratorischen Epithels. Wir führen die Untersuchung generell an Trachea- oder Hodengewebe durch, um optimale Ergebnisse zu erzielen.
Um eine auswertbare Morphologie zu gewährleisten, muss das Gewebe mit Glutaraldehyd fixiert werden, das wir auf Anfrage zur Verfügung stellen. Aus diesem Grund bitten wir darum, vor der Probeentnahme Kontakt mit uns aufzunehmen. Bitte beachten sie auch, dass die Aufarbeitung und Beurteilung dieser Proben sehr zeitaufwendig ist und Sie mit einem Resultat frühestens nach zwei Wochen rechnen können.
Literatur
- Beck JA, Ard M, Howerth EW, 2014. Pathology in practice. Primary ciliary dyskinesia (PCD) with associated bronchopneumonia, bronchiectasis, and hydrocephalus in a dog. J Am Vet Med Assoc 244(4), 421-423.
- Edwards DF, Patton CS, Kennedy JR, 1992. Primary ciliary dyskinesia in the dog. Probl Vet Med 4(2), 291-319.
- Watson PJ, Herrtage ME, Peacock MA, Sargan DR, 1999. Primary ciliary dyskinesia in Newfoundland dogs. Vet Rec 144(26), 718-725.
Schnellschnittuntersuchung während laufender Operationen
Die histologische Untersuchung operativ entnommenen Gewebes während einer noch laufenden Operation kann wichtige Entscheidungshilfen bieten. Diese Untersuchung ist anhand von Gefrierschnitten möglich. Sie erlaubt die Abgrenzung reaktiver Veränderungen und neoplastischer Zubildungen und unter Umständen die Bestimmung der Dignität letzterer. Ausserdem ist eine Tumorbettuntersuchung möglich, die Aussagen zur Vollständigkeit der Exzision erlaubt.
Eine Schnellschnittuntersuchung steht von Mo-Fr in der Zeit von 8:00 bis 15:00 Uhr sowohl für die Kliniken der Vetsuisse-Fakultät als auch für externe Kund*innen zur Verfügung.
Bitte beachten Sie, dass wir ausdrücklichempfehlen, den möglichen Einsatz der Schnelldiagnostik vor der Operation kurz mit dem/r Patholog*in zu diskutieren. So können vorab wichtige Informationen auch für die Klinikseite ausgetauscht werden.
Die erfolgreiche Schnellschnittuntersuchung erfordert den folgenden Ablauf:
- Telefonische Anmeldung mit ausführlichem Vorbericht (inkl. Telefonnummer des/r zu informierenden Ärzt*in) bei/m diensthabenden Patholog*in (Tel. 044 635 85 84).
- Möglichst rasche Anlieferung (innert 30 Min.) der unfixierten Gewebeproben an das Histologielabor des Instituts für Veterinärpathologie (Diagnostikgebäude (Winterthurerstr. 268), 1. Stock, Raum 125). Späteste Annahmezeit ist 15:00 Uhr.
- Das Labor präpariert und färbt Gefrierschnitte von den Proben.
- Die Befunde werden Ihnen innerhalb von ca. 30 Min. nach Erhalt der Proben telefonisch übermittelt.
- Die schriftliche Befundung erfolgt im Anschluss, so dass Sie den Bericht spätestens am Folgetag erhalten.
Am IVPZ steht ein hochwertiger Slide Scanner (Nanozoomer 2.OHT; Hamamatsu) zur Verfügung, mit dem zytologische und histologische Präparate (HE und Spezialfärbungen, Immunhistologie, Immunfluoreszenz) gescannt und digital zur Verfügung gestellt werden können. Dies ermöglicht die Beurteilung histologischer Präparate direkt am Computer. Der Service ermöglicht z.B. die Vorbereitung und Durchführung von Schnittseminaren oder anderen Weiterbildungsveranstaltungen, in denen lichtmikroskopische Präparate zur Verfügung stehen müssen. Des Weiteren erlaubt er auch internetbasierte Schnittdiskussion (second opinion cases etc.). Bei diesen Anwendungen wird der Zugang zu den Schnitten über einen Server gewährleistet. Alternativ und insb. für forschungsbezogene Zwecke besteht auch die Möglichkeit, die gescannten Präparate lokal auf den eigenen Rechner herunterzuladen und zu verarbeiten.
Mittels einer neu erworbenen Quantifizierungssoftware (Visiomorph) können digitalisierte Präparate automatisiert quantitativ untersucht werden. Auch diese Software kann als Teil unseres Service zugänglich gemacht werden. Falls Sie Interesse an diesem Service haben, bitten wir Sie, sich direkt an unseren Scannerbeauftragten, Professor Franco Guscetti (gufo@vetpath.uzh.ch) oder das Laboratory for Animal Model Pathology (LAMP ivpzlamp@vetpath.uzh.ch) zu wenden.
Wir bieten eine Fotodokumentation von makroskopischen Präparaten und von histologischen, zytologischen und/oder immunhistologischen Befunden an. Der Service könnte z.B. für forensische Fälle interessant sein, aber auch zur Weiterbildung genutzt werden. Bei Interesse wenden Sich sich bitte an den/die diensthabende/n Patholog*in, zur Dokumentation von Makrobefunden vorab, ansonsten zu jedem Zeitpunkt nach Bearbeitung des Falles.