Einsendungen Zytologiediagnostik
Seiteninhalt
Entnahme und Versand von zytologischen Präparaten
Für eine ausführliche Beschreibung der Probeentnahme und –verarbeitung empfehlen wir folgende Literatur:
-
R. L. Cowell, R. D. Tyler, J. H. Meinkoth, D. B. DeNicola: Diagnostic cytology and hematology of the dog and cat. Mosby, 2002
-
R. E. Raskin, D. J. Meyer: Canine and feline cytology; a color atlas and interpretation guide. Elsevier, October 2009
Allgemeines
Das Ziel eines Ausstriches ist es, ein Gebiet zu erhalten, in dem die Zellen einschichtig vorliegen und genügend abgeflacht, aber noch intakt sind, damit eine optimale Interpretation möglich ist.
Präparate so rasch wie möglich nach der Probengewinnung anfertigen.
Wird das Probenmaterial mit einer Spritze auf den Objektträger gegeben, sollte die Kanülenspitze den Objektträger leicht berühren. Das Material soll nicht aus grosser Distanz auf den Objektträger geschossen werden.
Zu langsame Trocknung oder zu dicke Ausstriche führen zu Zellveränderungen => Eingeschränkte Interpretation.
Kontakt mit Formalindämpfen vermeiden => Artefakte.
Wenn möglich, immer mehrere Ausstriche anfertigen => einzelne Ausstriche oft von unterschiedlicher Qualität und Aussagekraft.
Objektträger und Beschriftung
Objektträger mit Mattschild verwenden. Andere sind erfahrungsgemäss zu scharfkantig und schädigen unseren Färbeautomaten.
Mit Bleistift beschriften (Filzstift- oder Kugelschreiberschrift wird beim Färben abgelöst).
Keine Klebeetiketten verwenden, diese müssen abgelöst werden und Präparate bleiben danach wegen den Klebestoffresten oft im Färbeautomat hängen (Bruchgefahr).
Beschriftung: Patientenidentifikation (Name des Tieres/Tierhalter*in, Kunden-/Patientennummer) Bei Proben von verschiedenen Lokalisationen: Lokalisation der Probenentnahme, Entnahmedatum (insb. wenn mehrere Proben von verschiedenen Zeitpunkten vorliegen).
Feinnadelaspiration
Allgemeines
Am besten werden 5/10ml-Spritzen und gelbe oder schwarze Kanülen verwendet.
Tumorzytologie: Aspiration aus mehreren Bereichen des Tumors, zystische oder nekrotische Areale vermeiden.
Bitte wenn möglich mehrere Ausstriche herstellen. Zur Kontrolle, ob überhaupt aussagekräftige Zellen aspiriert wurden und nicht nur Blut, kann ein repräsentativer Ausstrich gefärbt werden (z.B.: mit Diff-Quik), um die Qualität unter dem Mikroskop zu überprüfen.
Technik (needle-on, mit Aspiration)
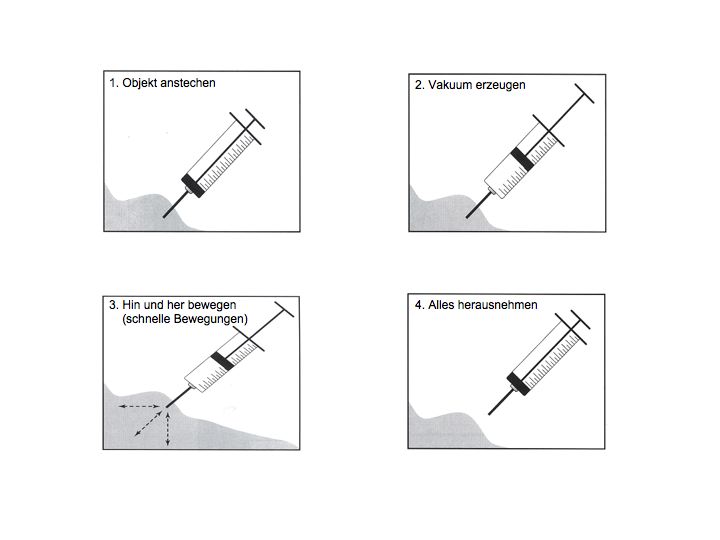
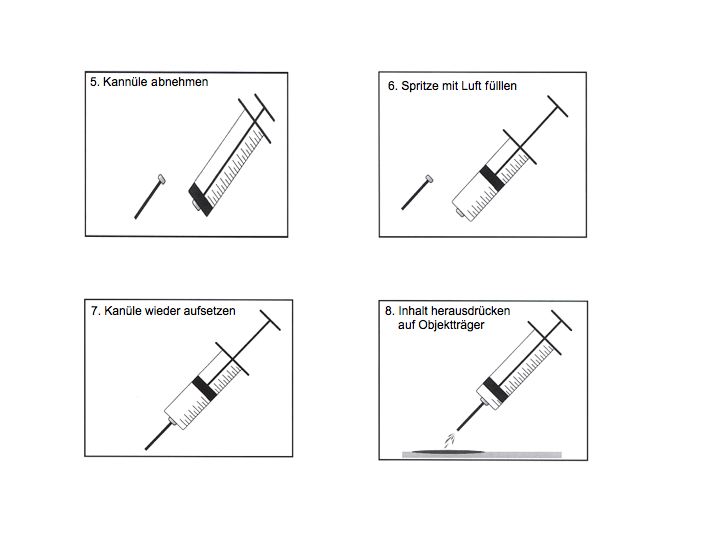
Beachte: Alternative Variante needle-off ohne Aspiration (empfiehlt sich für blutreiche Organe, Bsp: Milz)
Einsenden von Flüssigkeiten
-
Entnahme in EDTA Röhrchen
-
Direktausstriche herstellen (wenn möglich mehrere): einen Tropfen auf den Objektträger geben und vorsichtig ausstreichen (Blutausstrichtechnik).
Bitte Ausstriche mit “Direktausstrich” beschriften. -
Zentrifugat (bei zellarmen Flüssigkeit): Flüssigkeit zentrifugieren (1500 U/Min für 5 bis 10 Minuten) oder sedimentieren lassen. Überstand abpipettieren und Sediment ausstreichen (evt. vor dem Ausstreichen das Zellpellet mit einem gleich großen Rest der Flüssigkeit resuspendieren) und mehrere Ausstriche anfertigen.
Bitte Ausstriche mit “Zentrifugat” beschriften.
Die übrig gebliebene Flüssigkeit kann zwar zusammen mit den Ausstrichen mitgeschickt werden. Wir können sie jedoch nur in seltenen Fällen für die Herstellung weiterer Ausstriche verwenden, da die in der Flüssigkeit suspendierten Zellen sehr rasch autolytisch werden und nicht mehr beurteilt werden können.
Einsenden von Knochenmark
Eine sinnvolle Interpretation von Knochenmarksaspiraten ist nur in Kombination mit den Blutwerten möglich. Bitte schicken sie uns deshalb gleichzeitig mit Knochenmarksaspiraten auch die Werte der Blutuntersuchung, die wenn möglich nicht weiter als 48h Stunden zurückliegen sollte, und evtl. Blutausstriche.
Hinweise zur Probenentnahme finden Sie unter folgendem Linkveterinarymedicine-article
Literatur
Friedrichs KR, Young KM. Skills Laboratory: How to collect diagnostic bone marrow samples.
Präparateherstellung
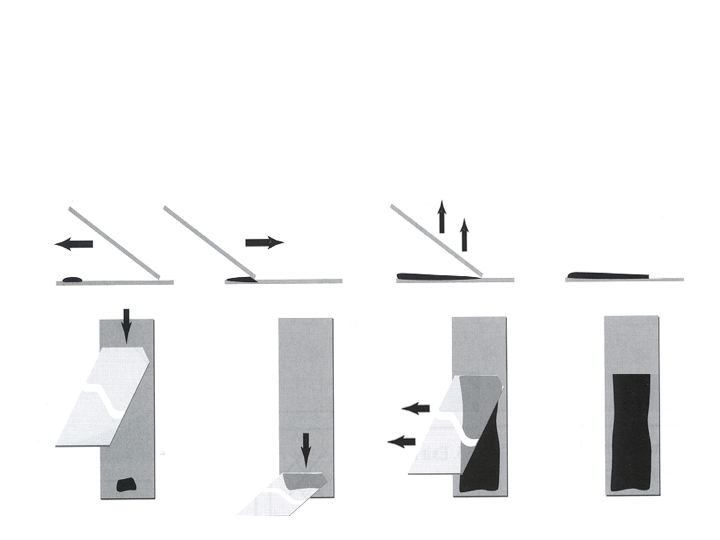
Auseinanderziehtechnik (= Squash Technik/Quetschtechnik)
Geeignet für: zähflüssige oder gewebige Proben, gewonnen mit FNA oder Schabetechnik
Technik
- Ein Tropfen der Probe auf den Objektträger geben
- Zweiter Objektträger leicht versetzt auf ersten Objektträger legen (Probe muss bedeckt sein)
- Probenmaterial verteilt sich zwischen den Objektträgern. Bei ungenügender Verteilung leichter Druck ausüben (CAVE: Quetschtechnik ist ein irreführender Name: bei zu viel Druck rupturieren die Zellen!)
- Objektträger ohne Druck auseinanderziehen
- Vor allem unten liegender Objektträger für Untersuchung geeignet

Blutausstrichtechnik
Geeignet für: Flüssige Proben, blutreiche Proben, Proben mit fragilen Zellen (z.B. Lymphozyten).
Technik
- Mit Spritze ein Tropfen Probenmaterial an den Rand des Objektträgers geben
- Zweiter Objektträger in Ausstrichrichtung im Winkel von 30 - 45° auf den ersten Objektträger aufsetzen
- Zweiter Objektträger auf Probe zubewegen, bei Berührung mit dem Tropfen verteilt sich das Material entlang der Kante des zweiten Objektträgers
- Zweiter Objektträger in einem Zug vorwärts bewegen, Probe wird auf dem ersten Objektträger ausgestrichen
- Ausstrich etwa über 2/3 der Länge des Objektträgers, mit Fahne

Linienausstrichtechnik
Geeignet für: Zellarme Punktate ohne Möglichkeit der Zentrifugation, zentrifugierte Proben, bei denen auch das Sediment immer noch eine sehr geringe Zelldichte hat
Technik
- Durchführung wie Blutausstrichtechnik
- Aber: Ausstrich endet nach 3/4 der Ausstrichdistanz abrupt (keine Fahne) und zweiter Objektträger wird abgehoben, es entsteht eine Linie mit erhöhter Zelldichte
- Der erhöhte Flüssigkeitsanteil der Ausstrichlinie verhindert aber eine deutliche Ausbreitung der Zellen und setzt so die Beurteilbarkeit der Zellen herab.
Trocknen
Ausstriche werden an der Luft getrocknet (keine Fixationsmittel verwenden) und können bei Raumtemperatur gelagert werden.
Artefakte
Formalindämpfe bewirken eine teilweise Fixerung der Zellen und führen so zu veränderten Färbeeigenschaften der Zellen. Dadurch können die Präparate oft nicht mehr beurteilt werden.
Werden Proben unter Ultraschallkontrolle entnommen, kann Gel auf das Präparat gelangen. Das Gel färbt sich intensiv pink an und kann Zelldetails überdecken.
Werden die Ausstriche nicht sofort angefertigt oder wird bei der Präparateherstellung zu viel Druck aufgewendet, kann es zur Zelllyse/-ruptur kommen.
Färbungen
Veterinärmedizinisch relevant sind die Färbungen nach Romanowsky (Diff-Quik® , May-Grünwald-Giemsa, Wright‘s etc.) und die Neu-Methylenblau-Färbung . Für diese Färbungen werden luftgetrocknete Präparate benötigt.
Luftgetrocknete Präparate lassen sich vor dem Färben einige Tage aufbewahren.
Fett wird beim Färbeprozess durch den Alkohol herausgelöst.
Postversand
Bitte nicht-biegbare Objektträgerbehälter für den Versand verwenden, evt. zusätzlich mit Zellstoff oder Polstermaterial umwickeln.
Bitte zytologische Präparate nicht mit Formalin-fixiertem Material zusammen einsenden (Formaldehyddämpfe reduzieren schon in sehr geringen Mengen die Färbequalität von zytologischen Präparaten erheblich).